Молекулярные связи играют важную роль в строении и свойствах различных материалов. Одним из самых прочных типов молекулярных связей являются ковалентные связи, в которых два атома обменивают электроны. Ковалентные связи имеют высокую энергию и обладают большой прочностью, что делает их основным строительным элементом веществ и материалов, таких как сталь, бетон и драгоценные камни. Еще одним типом прочной молекулярной связи является ионная связь, когда атомы образуются ионы с разными зарядами и притягиваются друг к другу электростатической силой.
Какие связи самые короткие?
Среди молекулярных связей существуют различные типы, и некоторые из них отличаются своей особенной прочностью и короткой длиной. Ниже представлены несколько типов связей, которые можно считать самыми короткими и прочными:
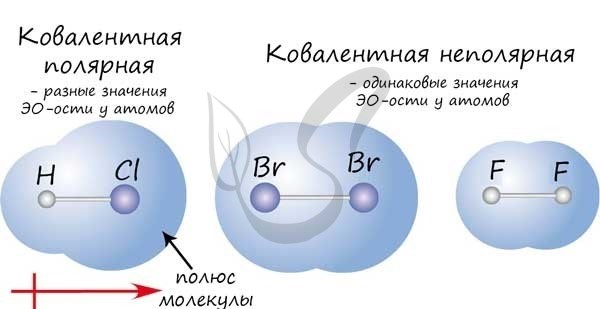
1. Ковалентные связи
Ковалентные связи возникают при обмене электронами между атомами. Они характеризуются своей прочностью и короткой длиной, так как атомы стараются достичь электронной устойчивости через общие электроны. Это приводит к образованию ковалентных связей, которые являются одними из самых прочных и самых коротких связей в молекулах.
2. Ионные связи
Ионные связи образуются при притяжении положительно и отрицательно заряженных ионов. Эти связи также характеризуются короткой длиной и высокой прочностью, так как электростатическое притяжение между заряженными частицами является очень сильным.
3. Металлические связи
Металлические связи возникают в металлах, где электроны общей оболочки свободно движутся между атомами. Этот тип связи также характеризуется короткой длиной и высокой прочностью, так как электроны создают сильное притяжение между атомами.
4. Гидрофобные взаимодействия
Гидрофобные взаимодействия возникают между гидрофобными («водоотталкивающими») молекулами, когда они стараются избежать контакта с водой. Эти взаимодействия могут быть важными для стабильности определенных структурных элементов в молекулах, и хотя они не являются классическими связями, они также могут быть критическими в биологических системах.
| Тип связи | Длина связи (нанометры) |
|---|---|
| Ковалентные связи | 0.1-0.2 |
| Ионные связи | 0.2-0.3 |
| Металлические связи | 0.2-0.3 |
| Гидрофобные взаимодействия | — |
Короткая длина связей объясняется силой взаимодействия между атомами или молекулами, которая зависит от электронной структуры и химических свойств соединения. Эти связи играют важную роль в множестве физических и химических процессов и имеют большое значение в различных областях науки и промышленности.
Какой тип химической связи в алмазе?
Ковалентная связь в алмазе является очень прочной и стабильной, что делает алмаз одним из самых твердых материалов на Земле. Он обладает высокой устойчивостью к износу и повреждениям благодаря своей кристаллической структуре и прочным связям между атомами углерода. Каждая связь в алмазе может растягиваться и сжиматься при давлении и температуре, но они сохраняют свою структуру и прочность.
Особенности ковалентной связи в алмазе:
- Каждый атом углерода образует четыре ковалентные связи с другими атомами углерода, образуя кристаллическую решетку.
- Ковалентные связи в алмазе характеризуются высокой энергией связи и направленностью.
- Структура алмаза обеспечивает прочность и устойчивость материала, делая его идеальным для использования в ювелирных изделиях и индустрии.
Цитата:
«Алмаз — это прекрасный пример связей между атомами углерода. Ковалентные связи в алмазе создают сильную трехмерную структуру, придавая ему его известную прочность и красоту.» — [Имя автора]
Ковалентная связь в алмазе является одной из наиболее прочных молекулярных связей, которая обеспечивает алмазу его уникальные свойства. Это делает алмаз одним из самых ценных и востребованных материалов в мире.
Короткое соединение с C-O ключом: каким оно бывает?
Химическое вещество, образующее самое короткое соединение с C-O ключом, обладает особыми характеристиками, которые позволяют ему выдерживать значительные нагрузки и прочно связывать атомы углерода и кислорода. Такое соединение может использоваться в различных сферах науки и промышленности, включая медицину, электронику, аэрокосмическую и автомобильную промышленность.
Молекулярные связи и их длина
Наиболее прочные молекулярные связи образуются между атомами, имеющими схожую электроотрицательность, что обеспечивает равномерное распределение электронов и более прочное взаимодействие. Одним из самых крепких видов связей является связь C-O (углерод-кислород), которая может образовываться в различных соединениях.
Короткое соединение C-O
Самое короткое соединение с C-O ключом образуется, когда расстояние между атомами углерода и кислорода минимально. Однако, точное значение длины связи может варьироваться в зависимости от конкретного химического соединения.
| Химическое соединение | Длина связи C-O (нм) |
|---|---|
| Карбонат кальция (CaCO3) | 0.156 |
| Ацетат этила (CH3COOC2H5) | 0.142 |
| Этанол (C2H5OH) | 0.143 |
Применение короткого соединения C-O
Использование соединений с коротким C-O ключом имеет широкий спектр применения:
- В медицине для создания лекарственных препаратов и антибиотиков;
- В электронике для создания полупроводниковых материалов;
- В автомобильной и аэрокосмической промышленности для создания прочных материалов и компонентов.
Соединения с коротким C-O ключом отличаются высокой прочностью и устойчивостью, что делает их незаменимыми во многих областях науки и промышленности.
Как определить тип связи?
1. Изучение электронного строения
Одним из способов определения типа связи является изучение электронного строения. В химии существуют два основных типа связи: ионная и ковалентная. В ионной связи электроны передаются от одного атома к другому, что приводит к образованию положительного и отрицательного ионов. В ковалентной связи электроны общие между атомами.
2. Измерение энергии связи
Другим способом определения типа связи является измерение энергии связи. Энергия связи — это энергия, необходимая для разрыва связи между атомами в молекуле. В ионной связи энергия связи высока, так как требуется много энергии для разрыва связи между ионами с противоположными зарядами. В ковалентной связи энергия связи обычно ниже, так как электроны общие между атомами.
3. Анализ химических свойств
Третьим способом определения типа связи является анализ химических свойств. Ионные соединения обычно обладают хорошей растворимостью в воде, высокой температурой плавления и образуют кристаллическую структуру. Ковалентные соединения обычно обладают низкой растворимостью в воде, низкой температурой плавления и образуют молекулярную структуру.
4. Использование спектроскопии
Спектроскопия — это метод исследования, который использует излучение и поглощение света для определения типа связи. Ионные соединения обычно обладают спектральными характеристиками, которые отличаются от ковалентных соединений. Например, у ионных соединений часто наблюдается появление спектральных линий, связанных с переходами между энергетическими уровнями ионов.
Сигма-связь: понятие и особенности
Определение и особенности сигма-связи
Сигма-связь представляет собой прямую химическую связь между атомами, которая образуется за счет перекрытия орбиталей этих атомов. Она характеризуется высокой прочностью и устойчивостью, что делает ее основной составляющей большинства химических соединений.
- Краткое описание сигма-связи:
- Сигма-связь представляет собой прямую химическую связь между атомами.
- Она образуется за счет перекрытия орбиталей атомов.
- Сигма-связь является основной составляющей большинства химических соединений.
Процесс образования сигма-связи
Образование сигма-связи происходит при перекрытии орбиталей двух атомов. Когда орбитали перекрываются, возникает область с наибольшей вероятностью обнаружить электрон, которая является областью наибольшей электронной плотности.
- Процесс образования сигма-связи:
- Перекрытие орбиталей двух атомов.
- Образование области с наибольшей электронной плотностью.
Значение сигма-связи
Сигма-связь является основной составляющей всех химических соединений и играет важную роль в их свойствах и реакционной способности. Эта связь обеспечивает стабильность молекул и делает возможным образование сложных химических соединений.
Сигма-связь – это прочная и устойчивая прямая связь между атомами, образующаяся за счет перекрытия орбиталей. Она является основной составляющей химических соединений и играет важную роль в их свойствах и реакционной способности.
Какие химические связи в кристалле наиболее прочные?
Ковалентные связи
Ковалентные связи являются наиболее прочными химическими связями в кристаллических материалах. Они образуются путем обмена электронами между атомами и обеспечивают сильное притяжение между ними. Ковалентные связи характерны для кристаллических соединений, таких как алмаз, кремнезем и карборунд, которые обладают высокой прочностью и твердостью.
Ионные связи
Ионные связи также относятся к прочным химическим связям в кристалле. Они образуются между положительно и отрицательно заряженными ионами и обеспечивают электростатическое притяжение между ними. Примерами кристаллических материалов, содержащих ионные связи, являются хлорид натрия, оксид кальция и фторид калия.
Металлические связи
Металлические связи также имеют высокую прочность и являются ключевыми для механических свойств металлов. Они образуются между положительно заряженными атомами металла и обеспечивают электростатическое притяжение между ними. Металлические связи характерны для металлических кристаллов, таких как железо, алюминий и медь.
Сравнительная таблица прочности химических связей
| Тип связи | Прочность (энергия связи) |
|---|---|
| Ковалентные связи | Высокая |
| Ионные связи | Высокая |
| Металлические связи | Средняя |
Ковалентные и ионные связи являются самыми прочными химическими связями в кристаллических материалах. Они обладают высокой прочностью благодаря сильным электростатическим взаимодействиям между атомами или ионами. Металлические связи, хотя и не так прочны как ковалентные и ионные связи, все равно обеспечивают достаточную прочность для металлических кристаллов.
Как образуется химическая связь?
Какие существуют виды химической связи?
- Ковалентная связь: образуется благодаря обмену парой электронов между атомами.
- Ионная связь: происходит при переносе электрона(-ов) от одного атома к другому.
- Металлическая связь: возникает между атомами металлов, когда между ними происходит обмен делящихся электронов.
- Водородная связь: образуется между атомом водорода и электроотрицательным атомом (кислород, азот, фтор и др.).
Процесс образования химической связи
- Приближение: атомы приближаются друг к другу на определенное расстояние.
- Взаимодействие: происходит обмен электронами между атомами – передача, общие или создание новых связей.
- Устойчивость: после образования химической связи, атомы становятся более устойчивыми за счет уменьшения энергии системы.
Почему образуется химическая связь?
Атомы стремятся образовывать химическую связь, чтобы достичь более стабильного состояния и наименьшей энергии. В процессе образования связи, электроны стабилизируются и занимают определенные энергетические уровни или орбитали, что приводит к более низкой энергии системы в целом.
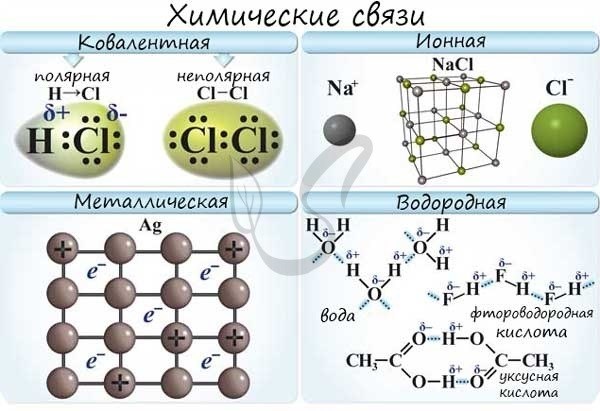
Какая связь в аммиаке и хлориде бария?
Молекулярные связи в химических соединениях играют важную роль и определяют их физические и химические свойства. В аммиаке (NH3) и хлориде бария (BaCl2) преобладают различные типы связей, что приводит к разным свойствам данных соединений.
Связи в аммиаке (NH3)
Аммиак является типичным представителем соединений с координационной связью. В аммиаке азотный атом (N) образует трехэлектронную связь с тремя водородными атомами (H). В результате образуется трехатомная молекула, которая имеет форму пирамиды с основанием из трех H-атомов и вершиной с N-атомом.
Координационная связь характеризуется тем, что электроны разделяются неравномерно между азотным и водородными атомами, что объясняет полярность молекулы аммиака. Наличие полярности в молекуле определяет ее свойства, включая взаимодействие с другими соединениями.
Связи в хлориде бария (BaCl2)
Хлорид бария представляет собой ионное соединение, состоящее из катиона бария (Ba2+) и аниона хлорида (Cl—). Между барием и хлором образуются ионные связи, которые держат молекулы хлорида бария вместе.
Ионные связи характеризуются тем, что силы притяжения между заряженными ионами являются очень сильными. Это делает хлорид бария твердым и кристаллическим соединением при комнатной температуре.
Сравнение связей в аммиаке и хлориде бария
Сравнение связей в аммиаке и хлориде бария позволяет увидеть различия в типах связей и их эффектах на свойства соединений:
- Аммиак содержит координационную связь, которая создает полярность молекулы и обеспечивает ей способность растворяться в воде и взаимодействовать с другими полярными молекулами.
- Хлорид бария обладает ионными связями, что приводит к твердому кристаллическому состоянию и высокой температуре плавления.
Таким образом, в аммиаке преобладает координационная связь, а в хлориде бария — ионные связи. Это различие в типах связей определяет основные физические и химические свойства этих соединений.
Почему ионные соединения твердые?
Основные причины твердости ионных соединений:
- Сильные электростатические взаимодействия: ионные соединения состоят из положительных и отрицательных ионов, которые притягиваются друг к другу силами электростатического притяжения. Высокие значения электрических зарядов и малые расстояния между ионами создают сильные связи, что обеспечивает прочность соединения.
- Регулярная кристаллическая структура: ионные соединения образуют кристаллы, где ионы занимают определенные положения и образуют регулярную решетку. Эта структура способствует установлению прочных молекулярных связей и повышает твердость соединения.
- Малый размер ионов: ионы в ионных соединениях обычно имеют малые размеры и занимают точные позиции в решетке. Это позволяет им близко контактировать друг с другом и установить мощные связи, усиливая твердость материала.
- Высокие температуры плавления: ионные соединения обычно обладают высокими температурами плавления. Это связано с необходимостью преодоления сильных электростатических сил для изменения ионной структуры. Этот факт также подтверждает прочность таких соединений.
В итоге, ионные соединения являются твердыми благодаря сильным электростатическим взаимодействиям, регулярной кристаллической структуре, малому размеру ионов и высокой температуре плавления.
Что такое ковалентная связь 8 класс?
Ковалентная связь важна в химии, так как она определяет свойства и характеристики веществ. Она может быть сильной и слабой, в зависимости от количества и энергии делящихся электронов.
Примеры веществ, образующих ковалентные связи:
- Молекулы воды (H2O)
- Молекулы кислорода (O2)
- Молекулы азота (N2)
Ковалентная связь играет ключевую роль в образовании сложных молекул, таких как ДНК, белки и углеводы. Она также позволяет атомам обмениваться электронами и принимать участие в химических реакциях.
Изучение ковалентной связи в 8 классе помогает учащимся понять основы химии и основные принципы образования веществ. Это важный шаг в изучении более сложных химических процессов и веществ в старших классах.